上期为大家介绍了澳大利亚IVD器械的监管机构、关键角色、分类、注册流程等内容,这次我们详细讲解下IVD器械的分类。
分 类
分类思路
分类是基于产品的预期用途以及错误结果造成的健康风险(公共风险/个人风险)程度而判断的。错误结果造成的风险越高,分类等级越高。
总结:分类等级= 预期用途 + 错误结果可能引起的公共卫生风险或个人风险程度。
分类参考标准
Therapeutic Goods (Medical Devices) Regulations 2002 Schedule 2A
Guidance: Classification of IVD medical devices
分类规则
澳大利亚分类规则共有8条,汇总至下表。澳大利亚的多条分类规则与IVDR的分类规则相似,个别分类规则会有差异,注意甄别。
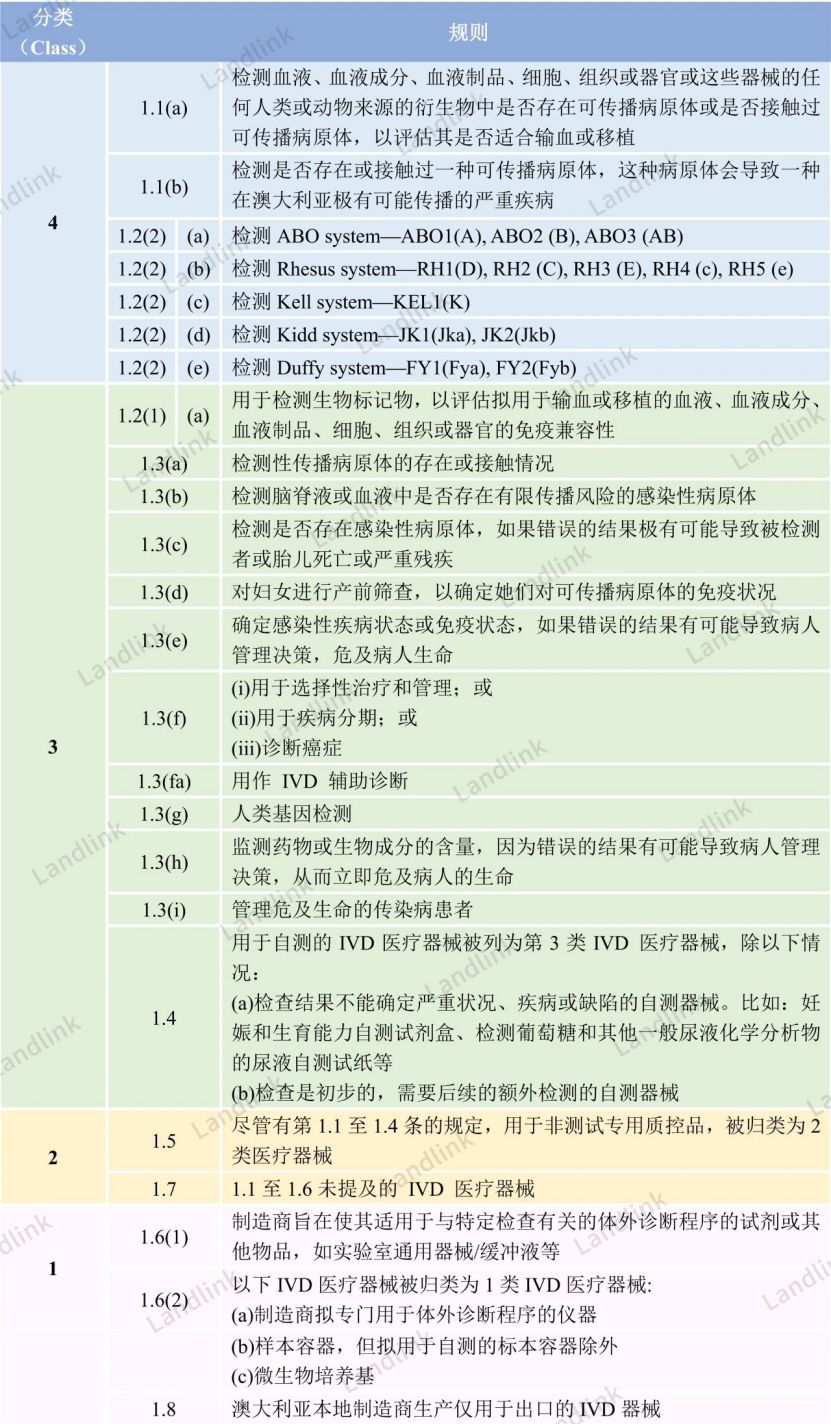
分类思考
1.IVD器械与其他医疗器械组合使用,如何分类?
若一个IVD器械需要与其他IVD器械、非IVD医疗器械或医疗器械附件组合使用,那么每个医疗器械必须单独分类。
2. 与IVD器械组合使用的IVD附件如何分类?
IVD附件:制造商特定用来与IVD一起使用的物品,以使该IVD能按预期用途使用。
附件与组合使用的IVD器械分开分类。
3. 软件如何分类?
a) 如果医疗器械受某一软件的驱动或影响,则该软件的分类与医疗器械相同。
b) 如果IVD软件没有驱动或影响IVD仪器,则根据该软件的预期用途进行分类。
4. 若IVD器械适用于多个分类规则,如何分类?
必须考虑所有分类规则,以确定IVD器械的正确分类。若IVD器械适用多个分类规则,则应用风险最高的分类。比如HIV自测产品同时适用于规则1.1(b)和1.4,分类等级分别对应为4类和3类,那么该IVD器械应归为风险等级最高的4类。
5. 医疗器械是系统和程序包(System or procedure pack),如何分类?
a) 全IVD器械
系统或程序包中有一个(或多个)IVD器械,则整个系统或程序包的分类选用其中单个IVD的最高分类。
比如,一个系统或程序包中包含1类、2类和3类IVD器械,则整个系统或程序包被归类为3类IVD器械。
b) 非全IVD器械
(i) 不同分类的IVD器械和医疗器械
一个系统或程序包同时包含不同分类等级的IVD器械和非IVD器械,则根据各自法规中的分类规则进行分类,应用分类级别最高医疗器械等级作为系统或程序包的分类。这也决定了系统或程序包是否作为IVD器械或非IVD器械纳入ARTG。
(ii) IVD器械和风险等级相似的医疗器械
当一个系统或程序包内既有IVD器械又有非IVD器械且风险分类相当时,则根据其主要预期用途对该系统或程序包进行分类。这决定了该系统或程序包是否作为IVD器械或非IVD器械列入ARTG。
GMDN
GMDN(全球医疗器械术语系统代码)是一套国际公认的描述符系统,是医疗器械产品命名、分类和归类的领先全球标准。GMDN术语(GMDN Term) 由 5位数代码、术语名称和定义组成。澳大利亚的医疗器械适用此套GMDN术语。
澳大利亚的IVD器械有自己的一套GMDN 术语,由CT+3或4位数字、术语名称和定义组成。

CT是GMDN数据库中的一个子集,被澳大利亚使用。在澳大利亚,GMDN Code是确定医疗器械“类别”的关键因素。
注意:如果申请中使用的GMDN术语不是最准确的,TGA可能会拒绝您纳入ARTG的申请。申请费不予退还!
GMDN的作用
制造商对他们的医疗器械进行分类
制造商、医疗服务提供商、监管机构和消费者在全球范围内始终如一地沟通
组织简化医疗器械审批和监控流程
当出现安全、性能或性能质量问题时,组织会共享信息
Landlink为您提供最优质的澳大利亚Sponsor服务及咨询服务,欢迎咨询!



