由于英国在2021年1月1日正式脱欧,自此,进入UK市场的制造商首先需向MHRA提出注册。下面我们来讲讲MHRA注册的细节,以及在GB和NI注册的不同之处。

在GB(英格兰+威尔士+苏格兰)注册
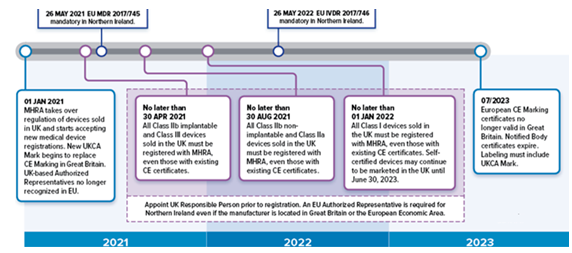
所有医疗设备,IVD和定制设备必须在MHRA上注册才能投放到GB市场。这适用于所有类别的设备。在英国(英格兰,威尔士和苏格兰),设备必须符合UK MDR 2002,EU MDR(至2023年6月30日)或EU IVDR(至2023年6月30日)才能在MHRA中注册。该MHRA只注册其中制造商或他们的英国负责人曾注册的营业地点在英国的设备。如果制造商位于英国以外,则他们必须任命在英国具有注册营业地点的英国负责人。然后,该英国负责人将承担制造商在MHRA中注册设备的责任。鉴于这是对现有注册要求的扩展,因此有一个宽限期,可以留出时间来遵守新的注册流程。必须按照下面列出的时间注册设备。2021年5月1日起将以下设备投放到英国市场,必须在MHRA中注册以下设备:
有源植入式医疗设备
III类医疗设备
IIb类可植入医疗设备
IVD List A产品
2021年9月1日起将以下设备投放到英国市场,必须在MHRA中注册以下设备:
IIb类非植入式医疗设备
IIa类医疗设备
IVD List B产品
自检IVD
2022年1月1日起将以下设备投放到英国市场,必须在MHRA中注册以下设备:
一类医疗器械
普通体外诊断设备
北爱尔兰(NI)的医疗器械
法规根据《北爱尔兰议定书》的条款,将医疗器械投放到北爱尔兰市场的规则与适用于英国(英格兰,威尔士和苏格兰)的规则不同。北爱尔兰依旧跟随欧盟的脚步,欧盟MDR和EU IVDR将于2021年5月26日和2022年5月26日分别在北爱尔兰生效。进入北爱尔兰市场的医疗器械需要CE标记。此外,如果英国认证机构进行强制性第三方合格评定,则必须使用UKNI标记。在北爱尔兰市场上出售设备时,英国制造商必须任命欧盟或北爱尔兰授权代表北爱尔兰市场上的某些医疗器械,包括体外诊断医疗器械,需要在MHRA注册。北爱尔兰制造商和总部位于北爱尔兰的授权代表在市场上投放的I类设备和一般ivd必须在2021年1月1日前注册,因为注册时间不适用于这些设备。对于其他设备类别,设备必须在以下日期注册:
2021年5月1日起,III类和IIb类植入物,以及所有有源植入医疗设备和IVD清单A产品必须注册2021年9月1日起,其他IIb类和所有IIa类设备和IVD清单B产品和自检IVD必须注册。
联系我们
如需了解更多信息,请与我们联系:
电话:021-80317636
邮箱:info@landlink-healthcare.com



