“一带一路”建设是在我国构建全方位开放新格局,深度融入世界经济体系背景下提出的重大倡议,旨在促进经济要素有序自由流动、资源高效配置和市场深度融合,推动沿线各国实现经济政策协调。随着技术水平的发展,我国的医疗器械制造商也纷纷走出国门,尤其借着“一带一路”的东风,更多的医疗器械也出口到了这些国家。
那么,这些国家对于医疗器械的监管是什么样的呢?需要通过什么样的途径才能进入到这些市场呢?今天的一带一路系列,峦灵医疗将带您了解马来西亚的医疗器械法规。
马来西亚人口众多,医疗器械基本依赖进口,尤其是高端的医疗器械。
监管机构及其法规
马来西亚医疗器械管理局(MDA)负责医疗器械法规的执行和医疗器械注册。
自2016年7月1日起,马来西亚的“医疗器械法”规定所有境外制造商必须在MDA上注册其医疗器械。此外,所有境外制造商现在必须获得合格评定机构(CAB)认证才能获得其产品注册申请的MDA批准。
医疗器械的分类
马来西亚的医疗器械分类基于四层系统(A类,B类,C类和D类),风险最低的产品为A类,风险最高的产品为D类。分类规则类似于欧盟医疗器械指令MDD的分类。
境外制造商医械的注册路径
在美国,欧洲,加拿大,澳大利亚或日本获得授权的医疗器械可以大大加快审批流程,通常来说,对于此类医疗器械在马来西亚的注册路径如下图:
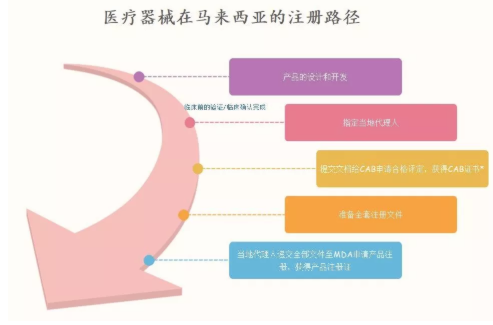
注:*仅针对于B,C,D类医疗器械
合格评定包括了质量体系、器械安全和性能以及产品注册三个方面。在整个合格评定的过程中,会涉及到制造商,合格评定机构(CAB)以及监管机构的共同参与。
注册证的有效期
产品注册证和CAB证书的有效期为五年。
我们能做什么?
- 确定您的产品分类和适当的注册路线
- 协助注册文档的准备
- 建议全球注册策略,以最大限度地减少注册和相关成本
- 如果需要,协助进行上市后监督,警戒系统以及不良事件的报告
联系电话:021-80316587



