合格评定程序
在医疗器械投放欧盟市场之前,制造商应对医疗器械的符合性进行评估(conformity assessment procedures)。其中,MDD为附录II~VII,MDR为附录IX~XI。
01合格评定程序-MDD
说明

I类 (S) I类灭菌医疗器械
I类 (M) I类带测量功能的医疗器械
附录II 全面质量保证体系,不包含II.4
附录II.4 EC 设计检查 (“设计文档评审”)
附录III EC 型式试验
附录IV EC 产品批检
附录IV (M) 测量功能部分的EC 产品批检
附录V 生产质量保证体系
附录V (S) 灭菌部分的生产质量保证体系
附录V (M) 测量功能部分的生产质量保证体系
附录VI 产品质量保证体系
附录VI (M) 测量功能部分的产品质量保证体系
附录 VII EC符合性声明
*) 无需公告机构进行评审.
**)对灭菌或测量方面的要求(见附录VII(5))
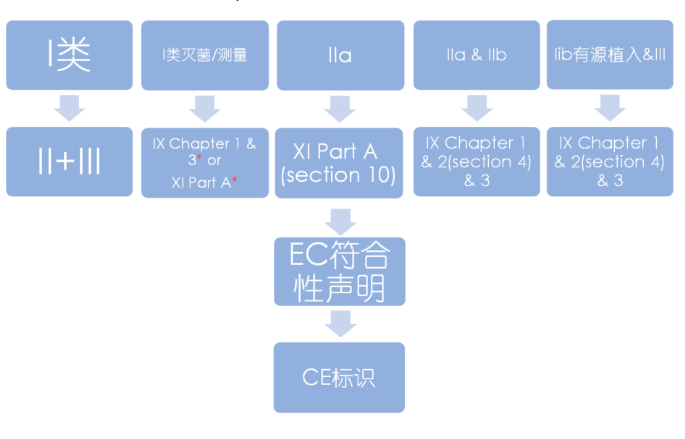
02合格评定程序-MDR
说明
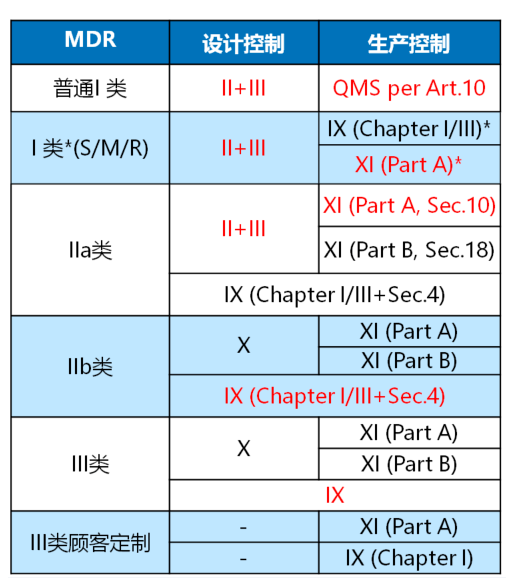
附录IX QMS+技术文件
- Chapter I: 质量管理体系
- Chapter II: 技术文件评审
- Chapter III: 行政规定
附录X 型式检查
附录XI 产品符合性验证
- Part A: 生产质量保证体系
- Part B: 产品验证
*) 针对MDR的I类灭菌、测量或重复使用产品,公告机构仅关注和保持无菌条件、计量要求和重复使用有关的内容。
-----------------------------------------
附录II 技术文件
附录III 有关上市后监督的技术文件
03MDR与MDD相似点

04 MDR常用路径图解